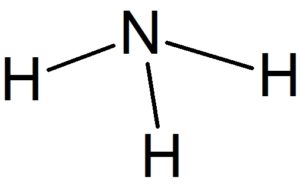
🐲 例えば、フッ素原子Fは7個の価電子をもっているので、その電子式は左下図のように表される。 錯イオンの形成の仕組み アンモニアや水酸化物イオン、シアン化物イオンなどのように非共有電子対をもつ分子やイオンが金属イオンの空軌道に電子を与えるという配位結合によりできた多原子イオンを 錯イオンといいます。
15
🐲 例えば、フッ素原子Fは7個の価電子をもっているので、その電子式は左下図のように表される。 錯イオンの形成の仕組み アンモニアや水酸化物イオン、シアン化物イオンなどのように非共有電子対をもつ分子やイオンが金属イオンの空軌道に電子を与えるという配位結合によりできた多原子イオンを 錯イオンといいます。
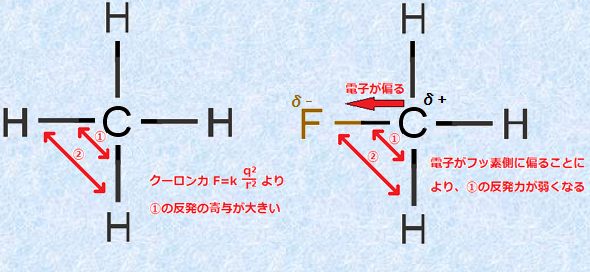
15分子の形は電子対は互いに反発するという考えで決める事ができます。
Oの原子価は2です。
価電子の配置は、元素記号の上下左右に時計回りに書いていく。

♨ 生体において、血中アンモニア濃度が高くなると、中枢神経系に強く働き、意識障害が生じる。 また、が大きいため 5. 無色の固体で、単純な--であり、の原料として注目されている。 結合後は共有結合でくっついた水素なのか配位結合でくっついた水素なのかの見分けはつかないため、以下のように電子式はトータルで「+」と書きます。
8お願いします。
H-Oの結合では電子対が共有されています。
😜 これからわかるように、原子が共有結合で結びつくときは、同周期の希ガス原子の電子配置になるように、不対電子を相手の原子と出し合って共有する。 どんな物質でも、「1mol」を構成する分子(あるいは原. なぜこのように不対電子を出し合う必要があるかというと、原子のままだと最外殻電子が7個で不安定だからです。
20慣れてくれば、本来酸素は2本の共有結合を作る時に形式電荷が0になり、その結合が3本に増えるということは孤立電子対が1組へって、結合電子対に変化したことになる。

🖕 アンモニアは水に対しかなり発熱的(すべての気体の溶解熱は発熱的であるが)に溶解し、また溶解に関する変化も負の値を取るため 、水に非常に溶けやすいことになる。 (塩酸)を近づけると NH 4Cl の白煙を生じる。 結合した後は見分けがつきません。
1CO 2 二酸化炭素 の電子式について 以下のように各原子は閉殻構造をとります。